
Los Llanos Orientales de Colombia y cultivos idóneos para condiciones de suelo y clima
March 1, 2025
La fertilización nitrogenada y su impacto en la productividad de los cultivos (Parte II)
July 23, 2025La importancia de escoger la fuente de nitrógeno para fertilizar los cultivos.
En términos de producción frutícola, es imprescindible tener claridad sobre ciertos conceptos clave acerca de los fundamentos de nutrición vegetal. En producción de frutas es tremendamente importante conceptualizar la importancia e impacto de la aplicación de nitrógeno al cultivo y su impacto en la productividad.
Primeramente, se debe tener muy en cuenta que aunque cuando se habla de fertilización con nitrógeno en los cultivos, es muy común hacer indistintamente referencia a cualquier fertilizante nitrogenado y el concepto clave predominante acerca de la aplicación de fertilizantes con el nitrógeno es aproximadamente que:
El nitrógeno le sirve a las plantas para formar tejido y fibra, para crecer, para ´ponerse de color verde´ y la ausencia de éste está relacionado con la falta de crecimiento de las mismas.
Siendo lo anterior tremendamente válido, es importante que se asocie a este concepto clave acerca de la aplicación de fertilizantes nitrogenados en los cultivos ciertas distinciones, igualmente claves, que pueden hacer la diferencia en cuanto al mayor o menor (e incluso negativo) impacto que estas aplicaciones pueden tener cuando estos fertilizantes son incluidos en el plan de aplicación de fertilizantes. Estos conceptos clave son los descritos a continuación.
El efecto de aplicar nitrógeno no es el mismo según la fuente que se utilice.
El nitrógeno puede aplicarse a través de fertilizantes en forma de urea, amonio o nitratos.
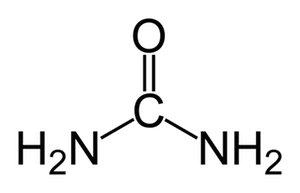
1. Nitrógeno ureico (urea)
Los fertilizantes nitrogenados con urea son los más comunes y baratos que se pueden adquirir debido a que la síntesis de la misma se da en complejos industriales inmensos para proveer a la agricutlura mundial.
Sin embargo, la urea en la naturaleza es el producto metabólico de los animales de la desaminación de las proteínas, y es por así decir, la fuente natural de fertilizantes nitrogenados más voluminosa que se encuentra en la naturaleza.
Pero a la vez ocurre algo bastante particular, la urea no puede ser absorbida directamente por las raíces de las plantas excepto en contadas situaciones. Las plantas no pueden suplementar sus necesidades de nitrógeno a partir directamente de la urea, es necesario que esta pase a otras formas químicas para poder ser abosorbida por las plantas.
La urea en el suelo pasa a la forma de amoníaco, una reacción que se da por hidrólisis, es decir, en presencia de agua.
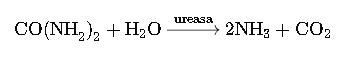
En este paso, y por medio de la enzima UREASA (proporcionada por bacteria específicas), la urea pasa a forma de amoníaco el cual es un gas, tóxico para las plantas y puede causar intoxicaciones.
Es así, que cuando la urea pasa a formar amoníaco, existe una gran probabilidad de pérdidas especialmente si el suelo está seco, el suelo está muy alcalino (con pH por sobre 7.5) o si la temperatura y el viento es muy fuerte. Es también por ello que es altamente recomendado que la urea se incorpore al suelo cuando se aplica para maximizar su efcienccia.
Posterior a esto, luego que la urea se ha transformado en amoníaco, este pasa a sintetizar amonio el cual sí es una molécula nitrogenada que es utilizada por la plantas.
La síntesis del amonio se da a partir del amoníaco y el agua del suelo, dado que también es una reacción de hidrólisis.
Como puede verse, la molécula de amonio es un catión por lo que en el suelo tiene poca movilidad y asimismo compite con el resto de los cationes del suelo.
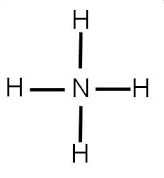
2. Nitrógeno amoniacal (amonio)
Tal como se ha mencionado, el amonio sí es una molécula nitrogenada de la cual pueden alimentarse directamente las plantas, ya que entra directamente por las raíces de las mismas, asimismo como la urea, puede ser aplicado directamente por medio de fertilizantes de síntesis química y puede decirse que es la segunda fuente más barata para aplicar nitrógeno al suelo en agricultura.
El amonio del que se alimentan las plantas, como se sabe ya, puede venir de aplicaciones de fertilizantes con urea o de aplicar directamente fertilizantes con amonio. Los efectos fisiológicos y en la rizósfera de aplicar amonio son los siguientes:
- El amonio en el suelo acidifica ligeramente durante su absorción.
- En suelos ligeramente alcalinos incrementa la disponibilidad de fósforo.
- Mejora la absorción de todos los microelementos que son metales (Zn, Cu, Fe y Mn) ya que acidifica ligeramente.
- Estimula las bacterias nitrificantes del suelo, que convierten el amonio en nitratos.
- Potencialmente puede desbalancear la relación de bases del suelo para cualquier cultivo.
- Incrementa crecimiento radicular SIEMPRE por sobre el crecimiento vegetativo.
- La nitrificación consume oxígeno, por lo que potencialmente puede causar crecimiento de bacterias anaeróbicas en suelos mal oxigenados.
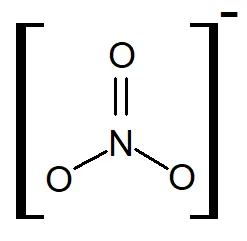
3. Nitrógeno nítrico (nitratos)
Los nitratos son compuestos nitrogenados que se pueden aplicar en formas de fertilizantes químicos que se industrializaron a partir del desarrollo del ácido nítrico a nivel industrial, que se hace reaccionar con sales para sintetitizar los nitratos que se usan a nivel agrícola.
Los nitratos se forman a partir del amonio del suelo, en la naturaleza o cuando se aplican fertilziantes con urea o con amonio. En general a la reacción mediante la cual el amonio pasa a forma de nitratos se le llama nitrificación (reacción REDOX – Óxido reducción, en la cual hay transferencia de electrones entre dos compuestos) que realmente ocurre en dos pasos biológicos que son la nitrosación y la nitratación, cuya reacción global es:
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.
En términos generales la reacción de nitrificación es un proceso que consume mucho oxígeno, por lo que el suelo debe estar oxigenado por lo que no ocurre en suelos inundados o tremendamente compactados, tampoco ocurre en suelos ácidos ya que el pH debe estar entre 6.5 y 8 y algo curioso es que las bacterias nitrificantes no dependen de materia orgánica para vivir sino que son bacterias quimioautótrofas pero sí requieren oxígeno para vivir porque son bacterias aeróbicas. Asimismo la nitrificación es una reacción biológica que se da en unas temperaturas no menores de 25 grados centígrados de manera óptima y con el frío se desacelera.
Los nitratos en el suelo son más moviles, ya que la molécula es un anión por lo tanto no se adsorbe con fuerza a las paredes de los coloides del suelo ya que tiene una carga negativa lo que hace que sea más proclive a perderse por lixiviación pero es a su vez una forma de nitrógeno más movil para las plantas. Los efectos fisiológicos y en la rizósfera de aplicar nitratos son los siguientes:
- Los nitratos incrementan ligeramente el pH del suelo, ya que liberan iones OH durante la nitrificación.
- La disponibilidad de fósforo puede reducirse en suelos alcalinos.
- Mejora la absorción de cationes (Ca, Mg y K) puesto que no compite por cargas eléctricas positivas.
- Tienen una movilidad muy alta en el suelo y pueden lixiviarse con facilidad.
- Los nitratos estimulan el crecimiento de la parte aérea de la planta, mucho más que el crecimiento radicular.
- Son muy móviles en el xilema y llegan al tejido de la planta muy rápido.
- Puede retrasar la maduración o florecencia de los cultivos si están presentes o se aplican en exceso.














